Forskning har visat att bakteriesammansättningen i människans tarmar kan påverka hälsan. Därför behövs ökad förståelse för bakteriella ekosystem i mag-tarmsystemet. I en nyligen publicerad studie i Journal of Biological Chemistry har forskare vid Chalmers kartlagt en tarmbakteries strategi för att konkurrera om näringsämnen från kostfibrer. Studien valdes ut som en av tidskriftens så kallade “Editors’ Picks”, det vill säga blev topprankad av dess redaktörer.
Tarmbakteriers system och strategier för nedbrytning av kostfibrer i den mat vi äter ser väldigt olika ut. Då forskningen kopplar vissa bakterier till hälsa och andra till sjukdom, är det viktigt med en grundläggande förståelse för hur de ”goda” bakterierna fungerar, till exempel hur de tävlar med andra tarmbakterier om näringsämnen.
Kemiska skyddsgrupper försvårar nedbrytning
Med hjälp av enzymer, proteiner som katalyserar kemiska reaktioner, bryter bakterier ner kostfibrers långa kolhydratkedjor (polysackarider) till enkla sockerarter som de kan äta. Vissa kolhydratkedjor skyddas av kemiska grupper, vilket gör det svårt för bakterierna att bryta ner dem.
− Hur bakterier i magen tar sig an dessa skyddsgrupper har inte har studerats så mycket tidigare. I vår studie har vi sett hur en magbakterie, Dysgonomonas mossii, bryter ner den komplexa polysackariden xylan. Det är en viktig beståndsdel i kostfiber, men är svårnedbrytbar då den skyddas av ett flertal kemiska grupper, säger Johan Larsbrink, docent i industriell bioteknik.
Hittade tre enzymer som tar bort xylans skyddsgrupper
Dysgonomonas mossii ingår i bakteriegruppen Bacteroidetes, en dominerande grupp i bakteriefloran i tarmen hos människan, som räknas till de goda bakterierna. Hos dessa bakterier återfinns de enzymer som klyver kolhydratkedjor ofta i stora genkluster i DNAt, så kallade polysaccharide ulilisation loci (PUL).
− Vi hittade tre intressanta enzymer, kolhydratesteraser, med olika egenskaper i ett sådant genkluster i vår bakterie och vi visade hur deanvänds för att klippa bort skyddande grupper från xylan, säger Cathleen Kmezik, doktorand.
Det stora genklustret som innehöll de tre esteraserna inkluderar även flera andra enzymer som kan klippa ner komplexa xylan-kedjor. Att dessa enzymer återfinns i samma kluster visar att det är viktigt för bakterien att kunna klippa bort skyddsgrupperna för att komma åt självakolhydratkedjan.
3D-struktur ger bättre förståelse för funktion
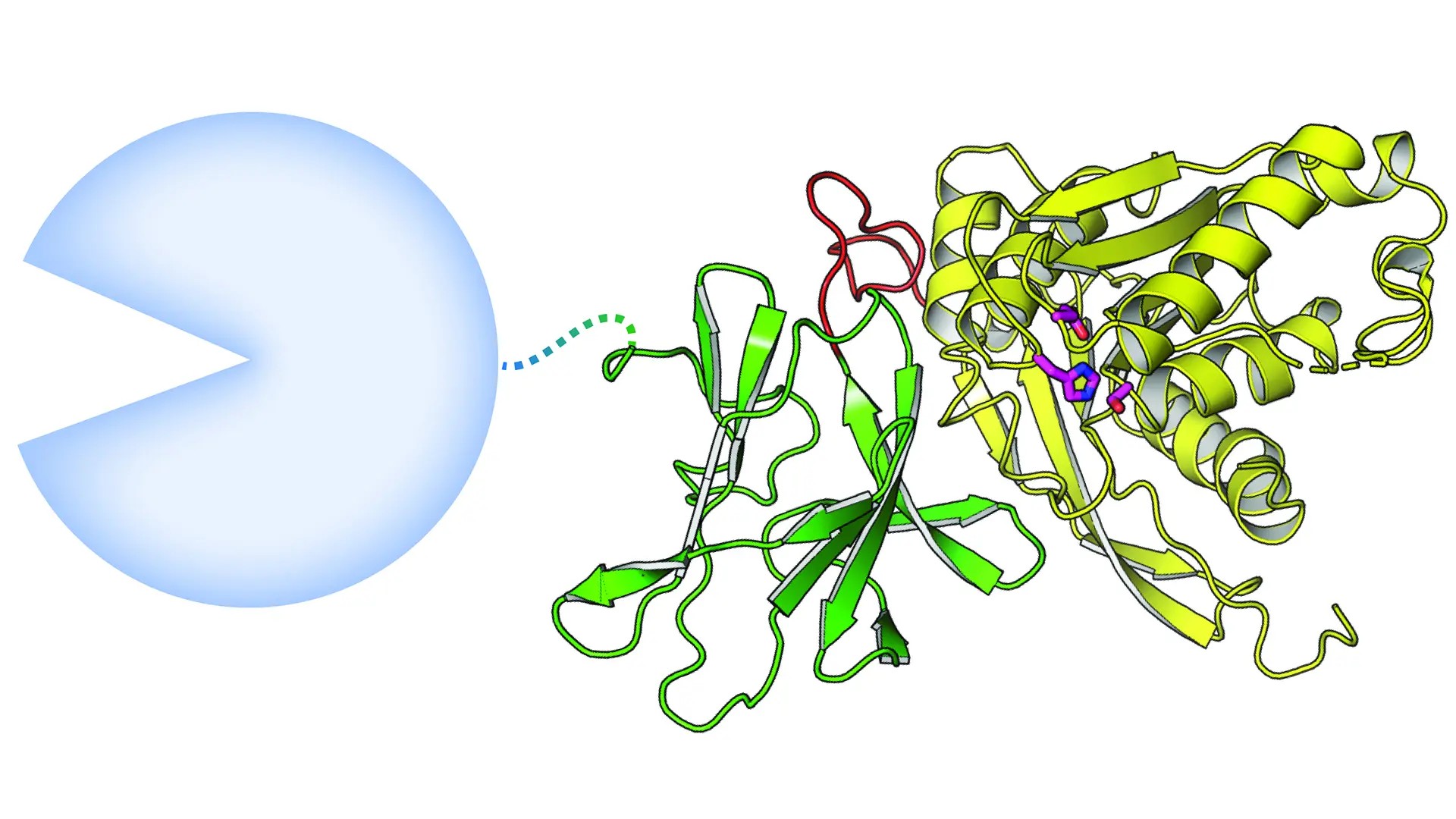
I studien upptäcktes också att ett av de tre enzymen är ovanligt eftersom det består av två ihopsatta aktiva, katalytiska, domäner. Om man liknar ett enzym vid en sax som klipper speciella kemiska bindningar kan man säga att det här enzymet består av två saxar som har kopplats ihop.
− Det kan alltså klippa olika kemiska bindningar väldigt nära varandra. Den ena delen av det här speciella enzymet var dock inte särskilt aktivt på de molekyler vi testade i våra labbförsök, men Scott Mazurkewich som arbetar som postdoktor i gruppen lyckades lösa dess 3D-struktur genom röntgenkristallografi. Det innebär att vi kan se exakt hur enzymet ser ut ner på en tiondels nanometerskala. Därmed får vi en bättre förståelse för vad enzymet skulle kunna göra ”på riktigt” i magen, säger Cathleen Kmezik.
Viktigt för överlevnad i tarmen
Funktionen för att klippa bort skyddsgrupper från kolhydratkedjor kan vara viktig för överlevnad i tarmen, enligt forskarna. Men mer forskning krävs för att fastställa vilka nischer olika bakterier har gällande vad de kan äta i tarmen − och om dessa nischer i så fall leder till ökad överlevnad och etablering under vissa förhållanden.
I framtida studier skulle man till exempel kunna låta olika bakteriearter växa samtidigt på olika kolhydrater med många eller få skyddsgrupper, och jämföra vilka som vinner kampen om näring. Enzymerna skulle också kunna användas industriellt för att snabba upp enzymatisknedbrytning av växtbiomassa för framställning av biobränslen.
Mer om studien och esteraserna
- Läs hela studien i Journal of Biological Chemistry: A polysaccharide utilization locus from the gut bacterium Dysgonomonas mossii encodes functionally distinct carbohydrate esterases
- DmCE1A: enzym från kolhydratesteras-familj 1 (CE1), aktivt på acetyl-estrar och klippte loss kumaryl-liknande molekyler med ännuokänd struktur från växtbiomassa.
- DmCE1B: enzym bestående av två katalytiska domäner från CE1 – DmCE1B_nt och DmCE1B_ct, sammanbundna med enkolhydratbindande domän. DmCE1B_nt är det enda av de tre enzymen med klar aktivitet på feruloyl-estrar som kan tvärbinda xylan-polysackarider, och var också aktivt på acetyl-estrar.
- DmCE1B_ct hade bara svag aktivitet på acetyl-estrar men dess 3D-struktur löstes tillsammans med den kolhydratbindande domänen. Strukturen tyder på att enzymet skulle kunna klippa större molekyler än de som testats på lab hittills (se figur ovan).
- DmCE6A: enzym från kolhydratesterasfamilj 6, med stark aktivitet på acetyl-estrar, både modellsubstrat och komplex biomassa. Enzymet visade sig kunna bidra till en mycket snabbare nedbrytning av xylan av enzymer som klyver själva kolhydratkedjan (xylanaser).
Kontakt
- Forskare, Industriell bioteknik, Life Sciences
- Docent, Industriell bioteknik, Life Sciences

